
【项目进展】河创院创新团队在骨质疏松治疗领域取得新进展
绝经后骨质疏松(POP)是女性雌激素缺乏引发的常见骨代谢疾病,其核心病理机制为骨微环境中活性氧(ROS)蓄积,通过 RANKL/RANK 通路促进破骨细胞生成,加速骨吸收,最终导致骨量流失和骨折风险升高。目前临床常用的激素替代疗法、双膦酸盐类药物等存在心血管疾病、颌骨坏死等严重副作用,亟需开发安全有效的新型治疗策略。
河创院安海龙教授、王金平副教授带领智能医疗创新团队通过绿色脂质体模板法合成了阿仑膦酸钠(Aln)修饰的大介孔铂纳米框架(Pt NF),并负载跨膜蛋白 16A(TMEM16A)通道抑制剂茶黄素(TF),构建了骨靶向纳米治疗系统 TF@Pt-Aln。该系统借助 Aln 与羟基磷灰石的强亲和力实现骨组织精准靶向,通过双重机制发挥治疗作用:一方面释放 TF 阻断 TMEM16A 通道,减少破骨细胞H⁺分泌,抑制RANKL-RANK通路,从而抑制破骨细胞分化;另一方面利用Pt NF和TF的固有抗氧化特性,广谱清除ROS,改善骨质疏松微环境(示意图)。体内外实验表明,TF@Pt-Aln显著增加去卵巢小鼠的骨小梁质量与微结构,疗效与阿仑膦酸相当,且大幅降低颌骨坏死风险,展现出优异的生物相容性,为绝经后骨质疏松的临床治疗提供了极具潜力的新方案。
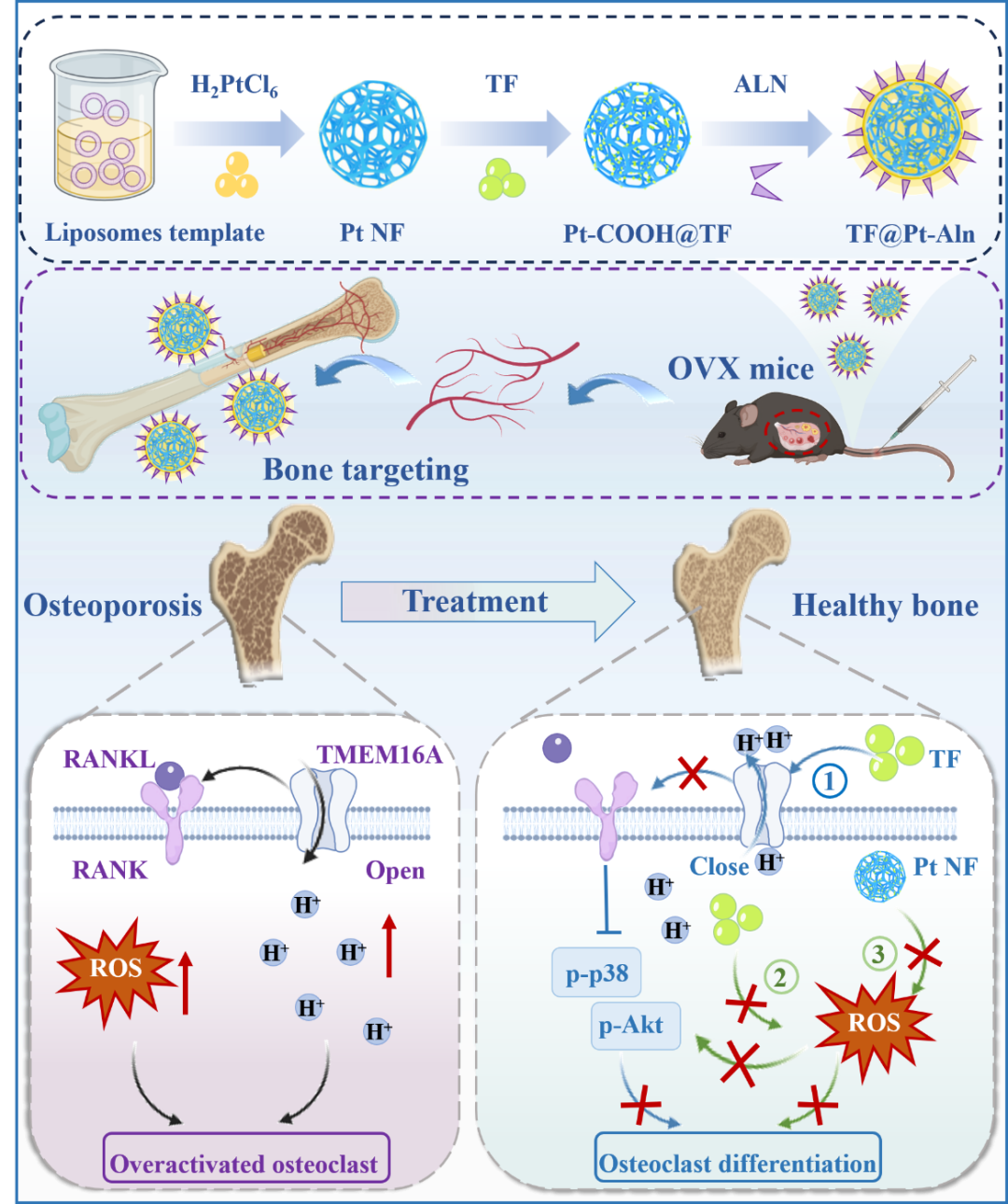
示意图:TF@Pt-Aln纳米系统通过清除ROS并阻断TMEM16A通道抑制破骨细胞,预防骨质疏松的骨靶向机制
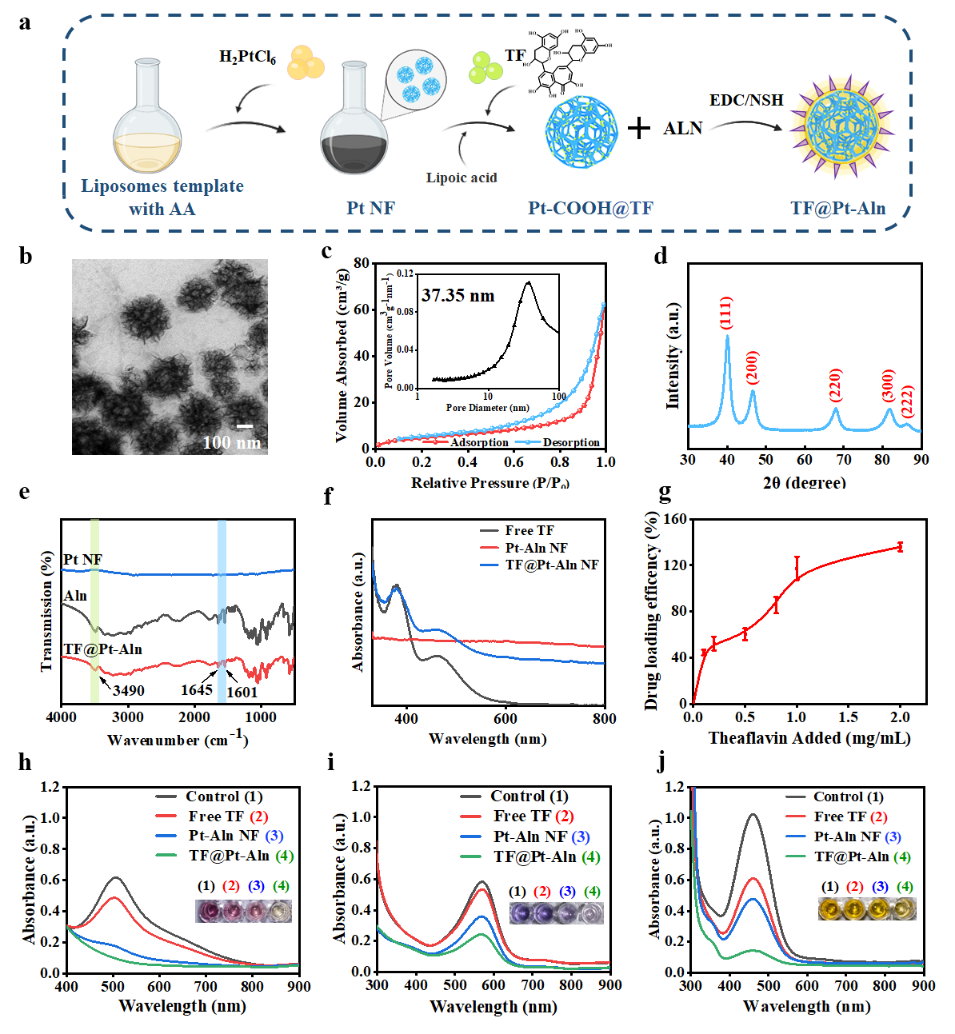
图1. TF@Pt-Aln纳米体系的表征
研究人员以脂质体为模板绿色合成了直径约100 nm、孔径约 37 nm 的大介孔铂纳米框架(Pt NF),通过表面共价连接骨靶向分子阿仑膦酸盐(Aln)、内部负载 TMEM16A 通道抑制剂茶黄素(TF),成功构建骨靶向纳米药物 TF@Pt-Aln。该纳米系统药物负载量高达 135.89%,且凭借Pt NF与 TF的协同作用,具备长效广谱的ROS清除能力(图1)。
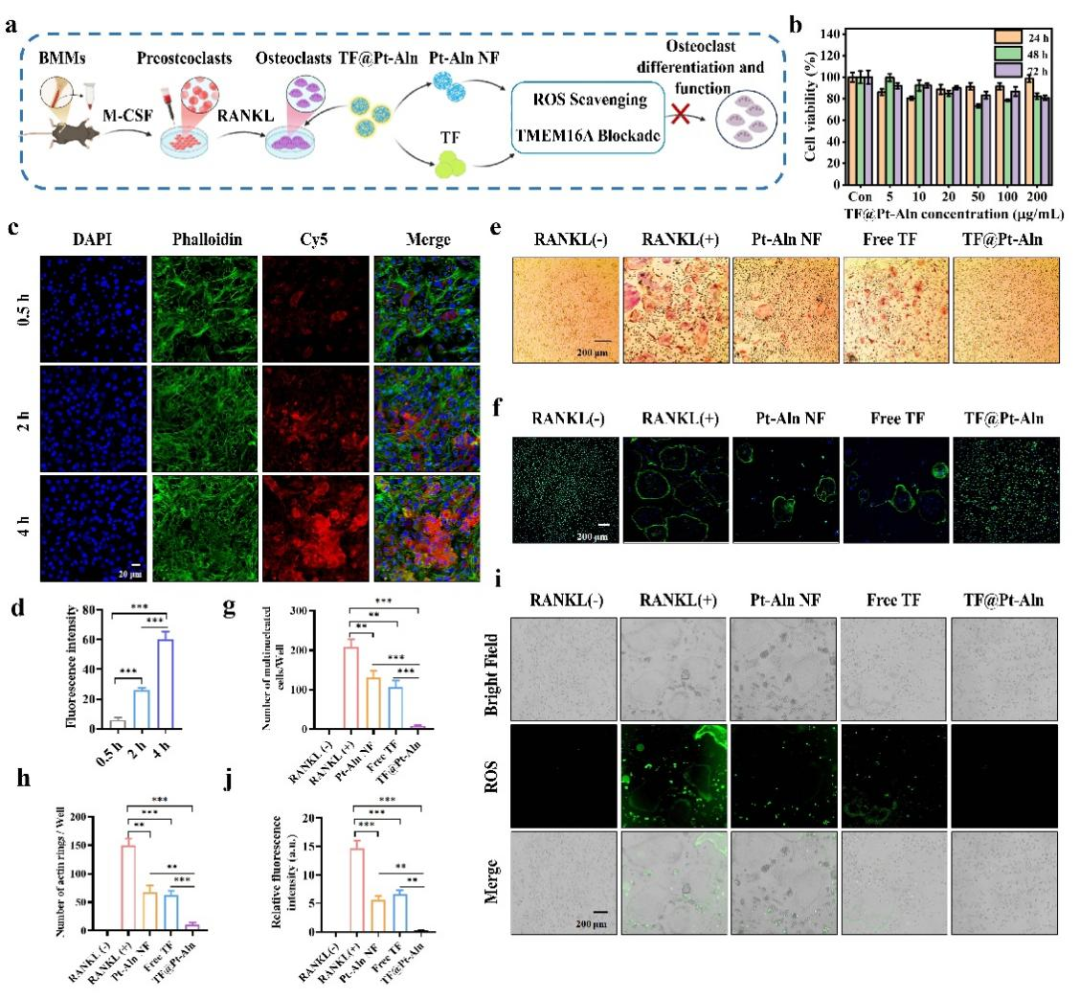
图2. TF@Pt-Aln纳米系统在体外对破骨细胞活性的抑制。
在此基础上,首先验证了TF@Pt-Aln的体外生物活性(图2)。该纳米药物具有优异生物相容性,对骨髓来源巨噬细胞(BMMs)无明显细胞毒性,破骨细胞对其呈时间依赖性摄取,能高效内化该系统。通过TRAP染色和肌动蛋白环染色观察到,TF@Pt-Aln 可显著减少多核破骨细胞数量、缩小肌动蛋白环尺寸,有效抑制破骨细胞分化与功能;同时其能高效清除RANKL诱导产生的过量ROS,为抑制破骨细胞分化奠定关键基础。
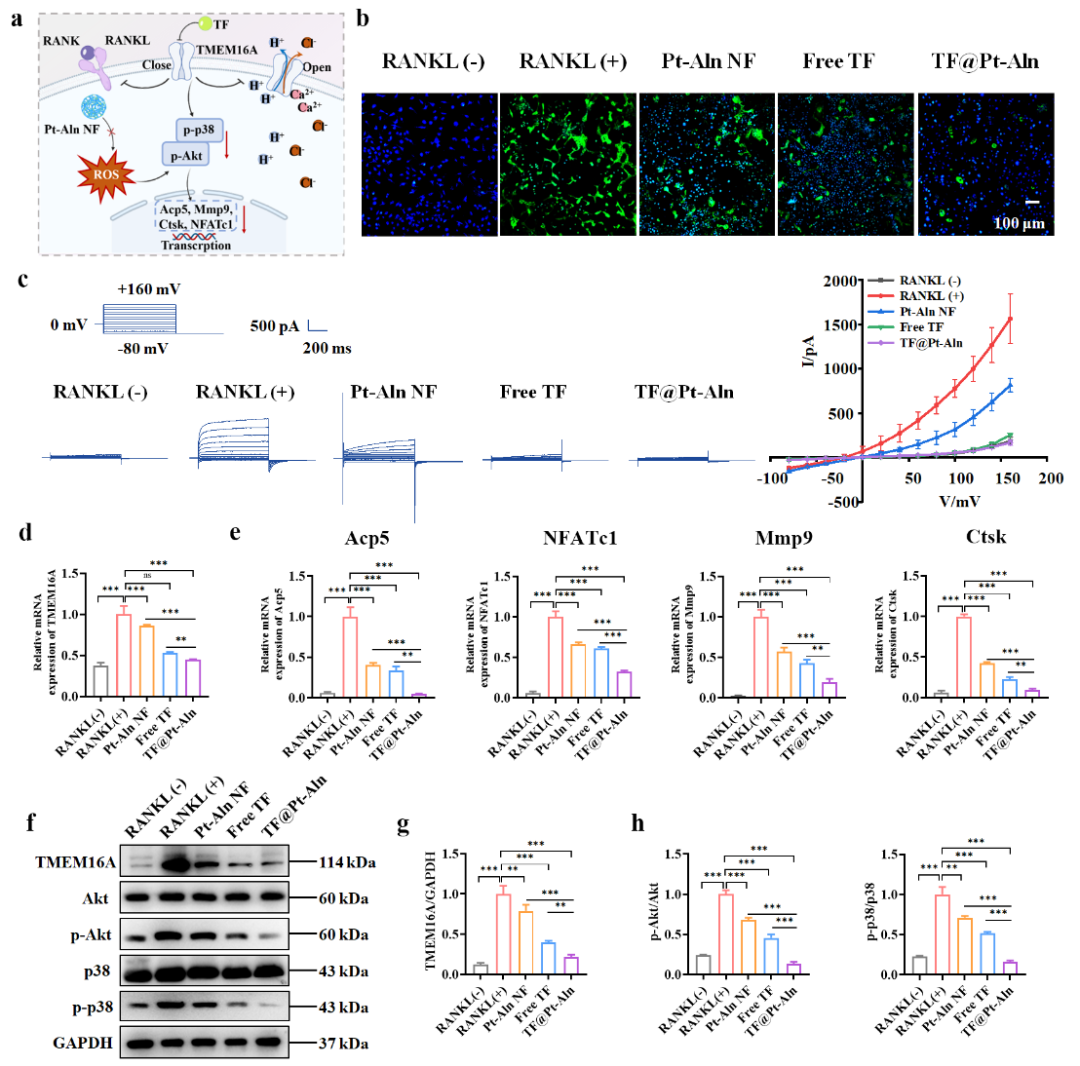
图3. TF@Pt-Aln纳米系统通过阻断TMEM16A通道并清除ROS抑制破骨细胞分化
进一步探究其作用机制发现,TF@Pt-Aln 通过“通道阻断+ROS清除”双重路径发挥协同调控作用(图3)。一方面,它能直接阻断TMEM16A通道并下调其蛋白与mRNA表达,减少破骨细胞H⁺分泌并恢复细胞内中性pH环境;另一方面,通过阻断RANKL-RANK通路下游AKT、p38 磷酸化,显著抑制破骨细胞标志基因表达。
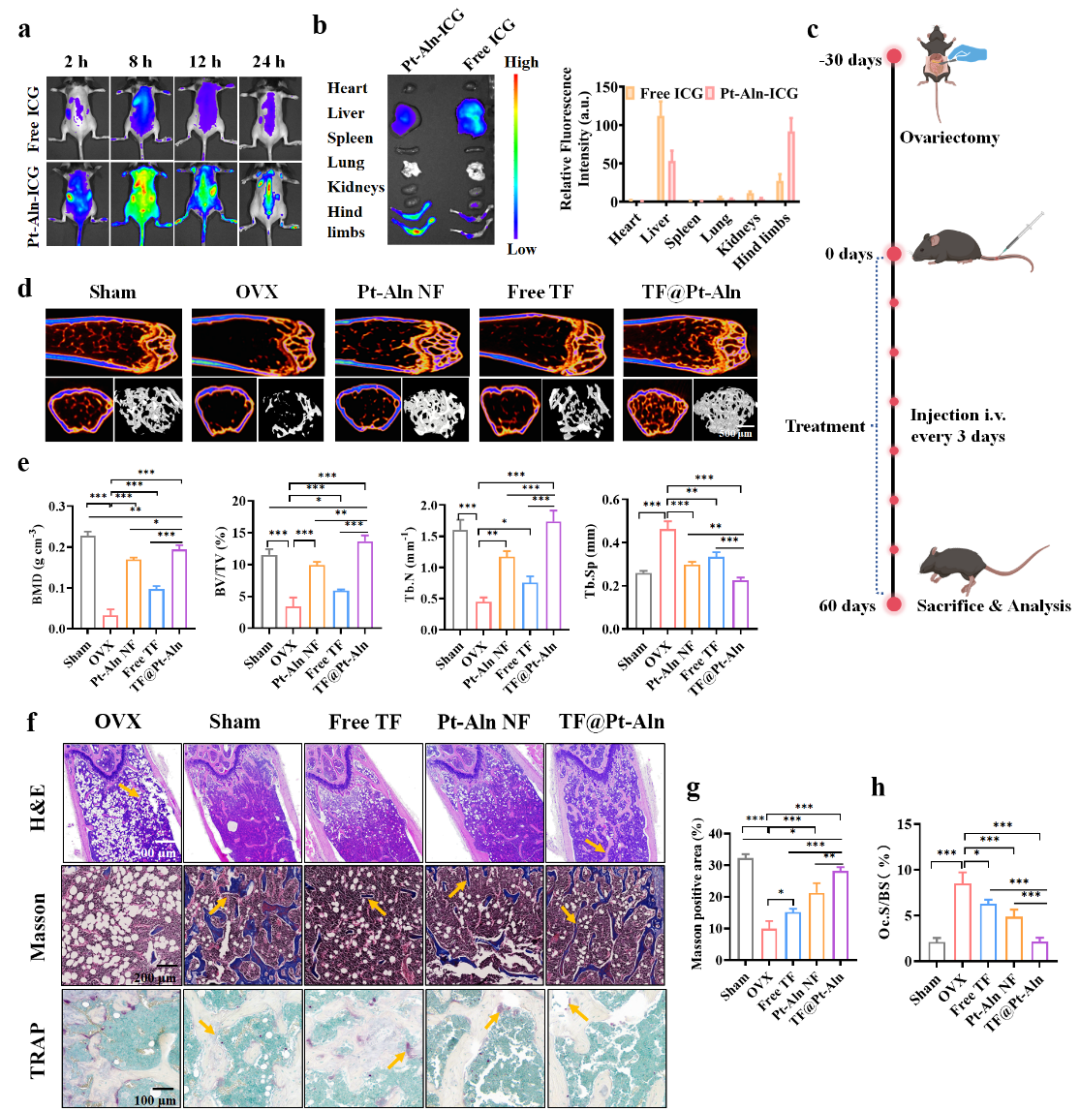
图4. TF@Pt-Aln纳米系统在OVX小鼠中的抗骨质疏松疗效
为进一步验证其在活体中的治疗潜力,开展了体内靶向性与疗效评估(图4)。活体成像实验证实,TF@Pt-Aln具有高效骨靶向能力,且血液循环半衰期更长,能实现骨组织长效滞留。在卵巢切除骨质疏松(OVX)小鼠模型中,连续8周的TF@Pt-Aln 治疗显著恢复OVX小鼠骨小梁微结构参数(BMD、BV/TV、Tb.N等),同时能抑制破骨细胞活性,促进新骨形成,有效逆转卵巢切除诱导的骨流失。
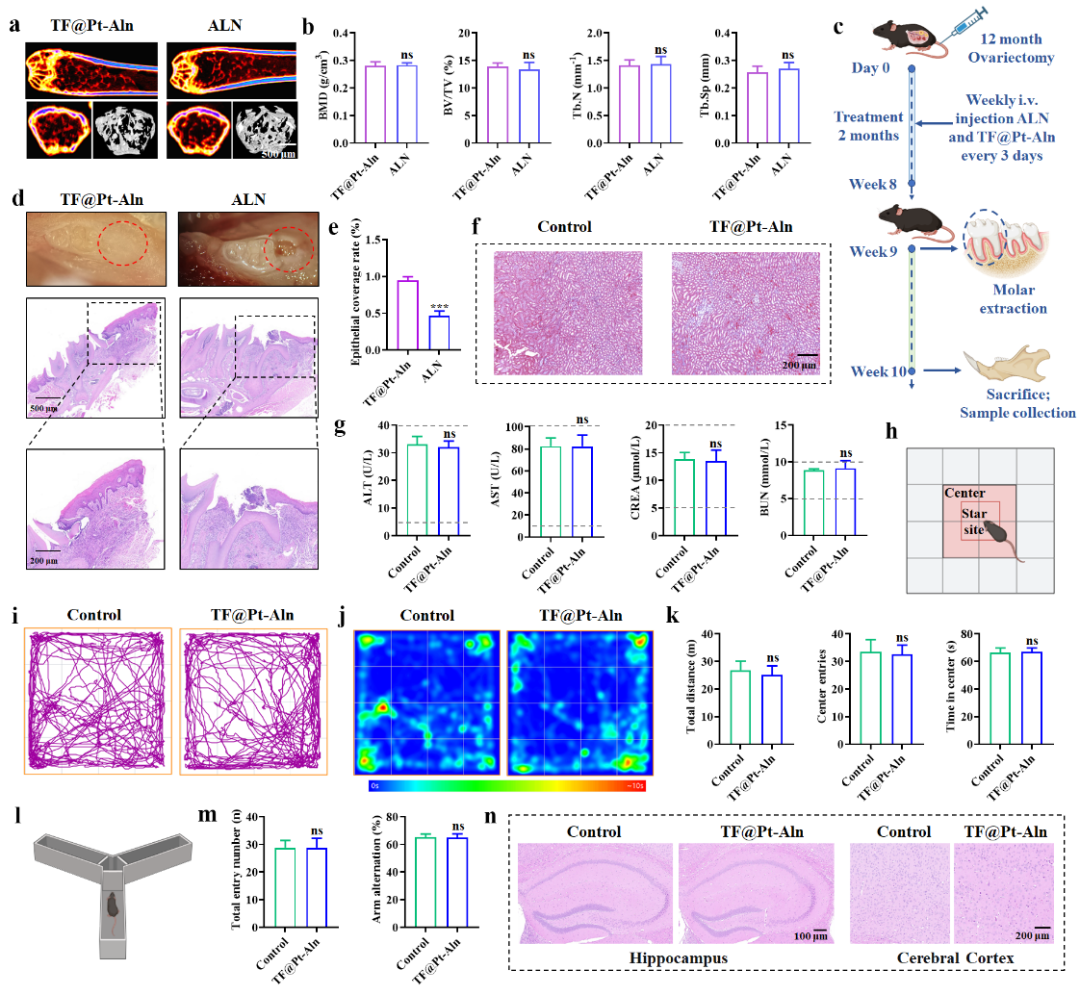
图5. TF@Pt-Aln纳米系统相比ALN降低了颌骨坏死风险。
在老年OVX小鼠拔牙模型中,TF@Pt-Aln疗效与阿仑膦酸相当但能够避免颌骨坏死等副作用。且长期毒性评价也显示,TF@Pt-Aln 治疗6个月后,小鼠未见主要脏器损伤、肝肾毒性及神经行为异常,证实其优异的生物安全性(图5)。且与另一种临床药物特立帕肽(Tep)相比也展现出相当的治疗效果,临床转化潜力显著。
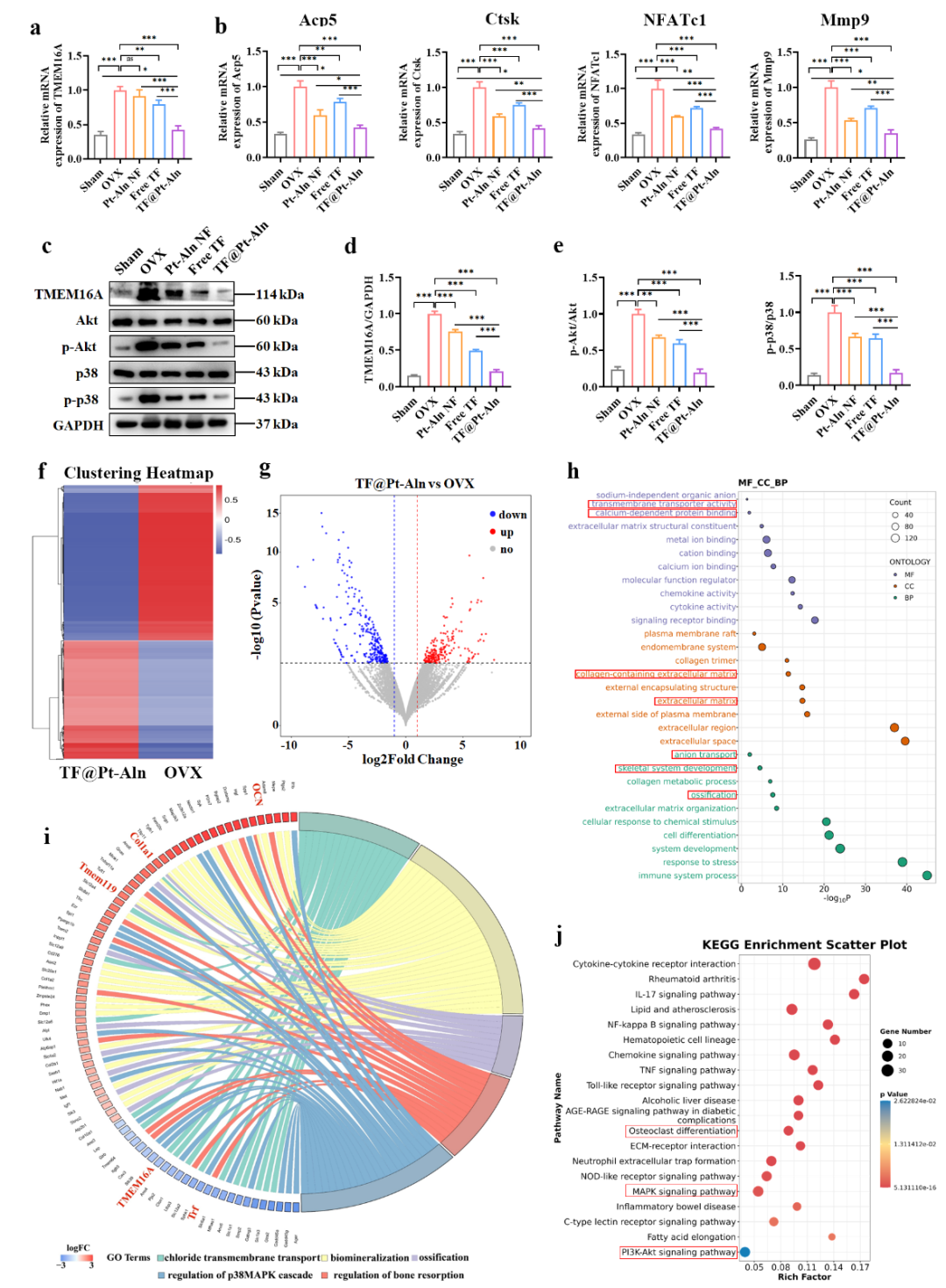
图6. TF@Pt-Aln纳米系统在体内抑制骨吸收的机制
为明确体内作用的分子调控网络,我们通过分子水平检测与RNA测序进行机制验证(图6)。结果显示,TF@Pt-Aln能显著下调小鼠骨组织中TMEM16A的蛋白和mRNA表达,同时抑制破骨细胞标志基因过度表达,并阻断RANKL-RANK通路下游信号传导。RNA测序分析发现,与OVX组相比,TF@Pt-Aln 处理后能够上调骨矿化相关基因(OCN、Scd1等),并下调破骨细胞活性相关基因(Ctsk等);GO和KEGG 富集分析证实其调控通路集中于MAPK、PI3K-AKT 信号通路及破骨细胞分化,进一步验证了其体内作用机制的特异性与可靠性。
本研究成功开发了集骨靶向、ROS广谱清除与TMEM16A通道阻断功能于一体的多功能纳米药物递送系统TF@Pt-Aln。该系统通过“通道抑制+ ROS清除”双机制协同作用,高效抑制破骨细胞活性与分化,在OVX小鼠模型中显著逆转骨流失,其抗骨质疏松疗效与临床一线药物相当。更重要的是,该纳米系统规避了双膦酸盐类药物易引发的颌骨坏死等严重副作用,且长期应用无肝肾及神经毒性,展现出优异的生物安全性,为POP的靶向治疗提供了全新策略。未来,团队将进一步优化纳米系统的制备工艺与给药方案,进一步探索其在大型动物模型中的长期药效与毒理学,推进其临床转化进程;同时探索该平台在其他骨代谢疾病及ROS相关疾病中的应用潜力,为更多疾病的精准治疗提供技术支撑。
该工作以“Bone-Targeted Platinum Nanoframework Prevents Postmenopausal Osteoporosis via Transmembrane Protein 16A Channel Blockade and Reactive Oxygen Species Scavenging”为题目发表于ACS Nano。论文第一作者为河北工业大学电气工程学院博士生史东鸿及理学院硕士生田梦,通讯作者为河北工业大学大学王金平副教授、安海龙教授。
通讯作者介绍

王金平
河北工业大学生命科学与健康工程学院副教授,硕士生导师。先后入选天津市第一批青年科技人才(第三层次),河北省教高等学校青年拔尖人才,河北工业大学元光学者等。主持国家自然科学基金青年项目、京津冀基础研究合作专项、石家庄市科技合作专项等多项科研项目。主要从事纳米材料对离子微环境的调控研究,目前,在该领域以第一作者或通讯作者身份在Advanced Materials, Advanced Functional Materials, ACS Nano, Bioactive Materials等期刊发表SCI论文30余篇。
通讯作者介绍

安海龙
河北工业大学创新研究院(石家庄)院长,生命科学与健康工程学院教授,博士生导师,河北省分子生物物理重点实验室主任、河北省生物物理重点学科负责人、河北省杰出青年科学基金获得者,河北省政府特殊津贴专家,天津市“离子通道靶标抗肿瘤药物研发”重点领域创新团队负责人,天津市 “五一”劳动奖章获得者,河北省物理学会副理事长、中国神经科学会离子通道与受体分会常务理事。主要研究领域为离子通道结构与功能关系、离子通道与重大疾病、离子通道靶标药物设计、纳米药物研发等方面。主持承担国家级、省部级项目20余项,在Nature Communications, Cell Reports, Bioactive Materials, Journal of Biological Chemistry, Pharmacological Research等顶级期刊发表SCI论文70余篇,获得授权国家发明专利10余项,作为第一、二完成人获得河北省自然科学二等奖各1项。